구성 아미노산 분석을 위한 시료 전처리 방법
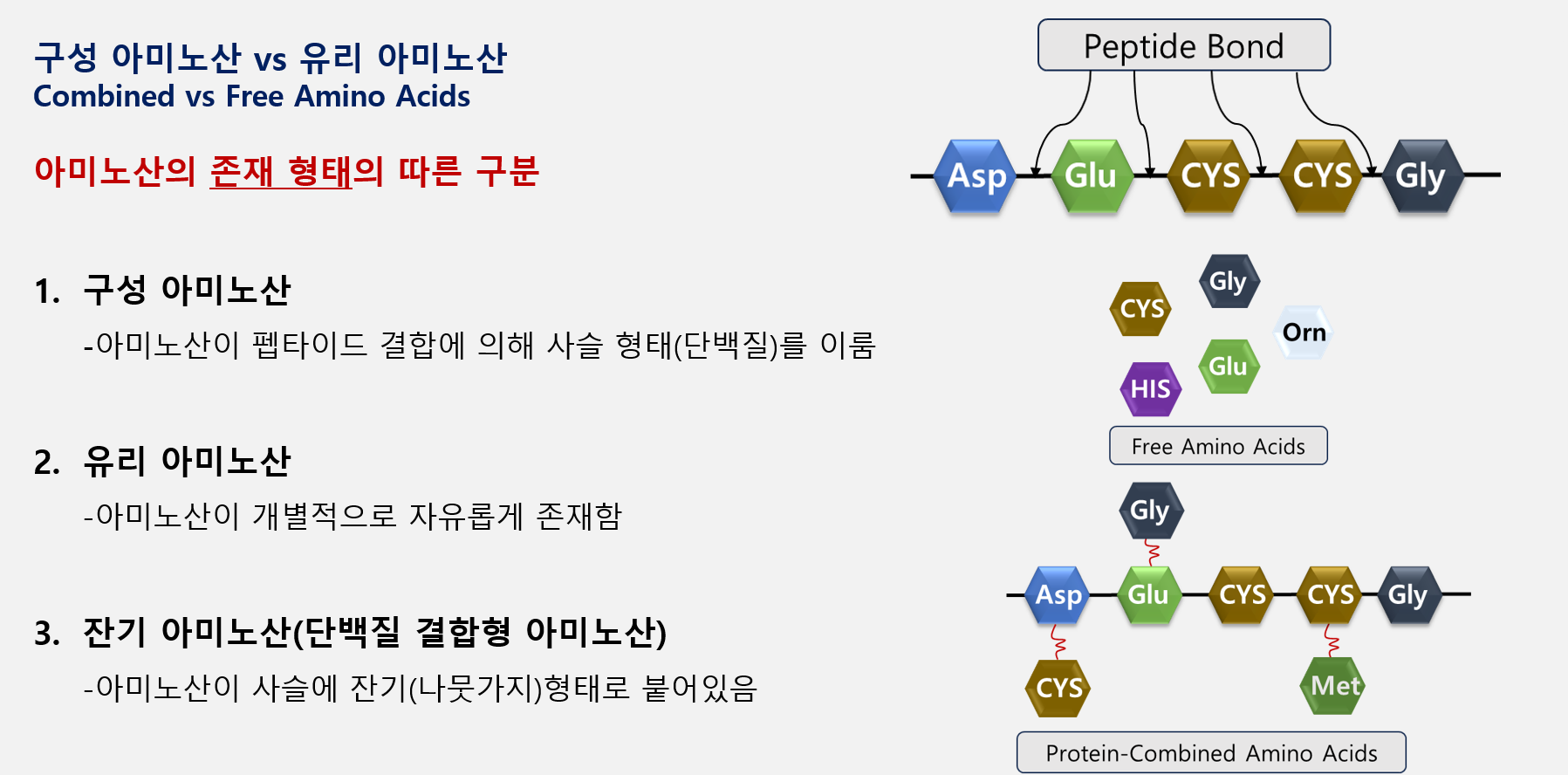
아미노산은 다양한 형태로 존재할 수 있습니다. 아미노산의 아미노기와 카복시기가 탈수 축합 반응하여 사슬 구조로 결합된 형태로 존재할 수도 있으며 아미노산이 개별로 존재하는 유리 아미노산 형태로 존재할 수도 있습니다. 또한 특이한 경우, 일반 단백질 사슬 구조에 곁사슬로 약하게 결합된 상태로도 존재할 수 있습니다. 우리가 흔히 말하는 구성 아미노산, 유리 아미노산이란 표현은 아미노산의 종류가 아닌 아미노산의 존재 형태에 따른 명칭입니다. 대표적으로 글루탐산(Glu; Glutamic Acid)는 단백질 사슬 구조 내에 존재하는 구성 아미노산이지만 반대로 혈청 및 혈장에서 개별 유리 아미노산 형태로도 존재할 수 있습니다.
아미노산의 종류에 따른 구분은 일반적으로 단백질 생성성(proteinogenic) 혹은 단백질 비생성성 아미노산으로 구분합니다. 이는 세포 내 DNA 혹은 RNA가 합성하느냐 안 하느냐로 결정됩니다. 즉, DNA가 합성하는 단백질 결합에 참여하느냐 안 하느냐로 일차적인 구분을 하게됩니다.
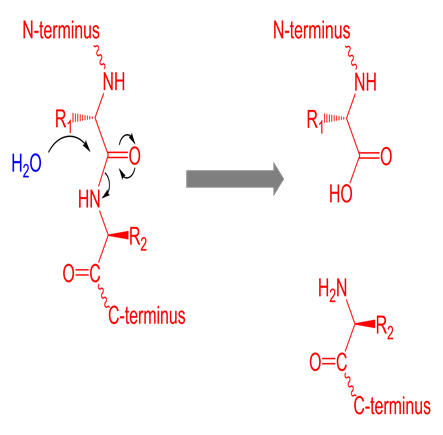
자동 아미노산 분석기를 통한 아미노산 분석을 위해선, 아미노산이 분리 가능한 형태인 개별 아미노산 형태, 즉 유리 아미노산 형태로 존재해야 합니다. 혈청, 혈장 등의 생체액 혹은 추출액, 주사제의 경우 이미 개별 아미노산 형태로 존재해 간단한 침전 및 여과 후 주입이 가능합니다. 반면에 단백질 및 폴리 펩타이드 형태로 존재하는, 일반적으로 고체상 시료의 경우 아미노산이 개별 유리 형태가 아닌 펩타이드 결합을 통해 사슬 구조로 이어져있는 방식으로 존재합니다. 이들을 분석하기 위해선 반드시 각 아미노산을 개별 유리 아미노산 형태로 유리시켜야 하는데, 이러한 과정은 일반적으로 염산을 이용한 가수분해 반응을 이용합니다.
< 펩타이드 결합의 가수분해 과정>
단백질성 시료 내 아미노산 정성 및 정량을 위한 가수분해 전처리 방법은 다양한 공정서가 존재합니다.
대표적으로 독일 농업 분석 및 연구 기관 협회(VDLUFA)의 VDLUFA 4.11.1 Amino Acids, AOAC의 AOAC Official Method 994.11 FEED and Regulation (EC) No.152/2009, 유럽 약전(Europoean Pharmacopeia)의 EP 5.0 2.2.56 AMINO ACID ANALYSIS 등의 국제적인 공정서가 있으며 국내에서도 식품의약품안전처 11-1471057-000554-01 건 강기능식품공전 시험법 해설서 3. 단백질 및 아미노산류 등의 공정서가 존재합니다.
이러한 공정서를 그대로 따라하는 것도 좋은 방법이지만, 시료 종류, 분석 환경, 장비 종류, 프로그램 종류 등 다양한 변수를 고려해 이러한 SOP를 사용자의 상황에 맞게 조절하는 것이 가장 추천되는 방법입니다. 본 문서는 Sykam 자동 아미노산 분석기를 통한 아미노산 분석을 위한 시료 전처리 방법을 다룹니다. 언급된바 사용자는 필요시 전처리 방법을 수정해 최적화하는 것이 권장되며 이러한 최적화 후에는 여러가지 교차 검증을 통해 해당 전처리 방법이 적합한 방법인지를 확인해야 합니다.
가수분해 방법은 크게 세가지로 나뉘는데, 6 M HCl 용액을 이용한 산 가수분해, 과의산을 통한 단백질 산화를 거치는 단백질 산화 및 산 가수분해, 트립토판 분석을 위한 염기성 가수분해로 나뉩니다.
1. 구성 아미노산 분석을 위한 산가수분해 전처리
단백질 생성성 아미노산, 혹은 구성 아미노산이라고 불리는 것은 일반적으로 단백질을 구성하는 구성 아미노산은 18~20 종의 아미노산이 대표적입니다. 아스파탐산(ASP; Aspartic Acid), 트레오닌(THR; Threonine), 세린(SER; Serine), 프롤린(PRO; Proine), 히스티딘(HIS; Histidine) 등이 대표적인 아미노산 입니다. 이들은 개별 아미노산들이 펩타이드 결합을 통해 사슬 구조로 결합된 상태로 존재합니다.
아미노산의 개별 분리 및 검출을 위해선 이러한 펩타이드 결합을 끊고 아미노산을 개별 유리 아미노산으로 분리시키는 과정이 필요합니다. 이 과정은 일반적으로 6 N 염산(Hydrochloric Acid) 용액을 사용합니다. 추가로 티로신의 산화 방지를 위해 0.1 ~ 0.5 % w/v 농도의 Phenol을 첨가하거나 아미노산의 펩타이드 결합을 방지하는 Mercaptoethanol 등을 첨가합니다.
6N 염산 용액을 이용한 산 가수분해 방법은 다음과 같습니다.
1. 시료를 동결 건조하여 수분을 제거한다.
2. 만약 시료에 다량의 지질(Lipid)이 함유돼있을 경우 속슬렛과 벤진(petroleum ether)을 이용해 지질을 제거한다.
3. 시료를 50 ~ 100 mg 정도 정확히 정량하며 내열 용기에 담는다.
*이때 용기 벽면에 묻는 시료를 최소화한다.
4. 시료에 4~5 ml의 가수분해 용액을 첨가한다.
*가수분해 용액은 추측되는 단백질 함량의 4~500 배 정도를 넣는다.
5. 유리관 윗면을 질소 가스로 퍼징해 잔여 산소를 제거하며 완벽하게 밀봉한다.
6. 10 분정도 초음파를 가해 시료를 완전히 용해시킨다.
7. 110oC 오븐에 22시간 이상 방치한다.
8. 충분히 상온에서 식힌 후 샘플을 중화한다. 이때 중화 방법은 크게 두가지로 나눌 수 있다.
8-1. 샘플을 회전 감압 증발 장치(Rotary Evaporator)를 이용해 염산을 증발시키고 물을 수차례 부어 충분히 중화한다.
8-2. 샘플을 pH 2.2 SDB 용액에 옮겨 1차 희석 후 4N NaOH를 이용해 화학적 중화를 시행한다.
9. 중화가 끝났다면 0.45 um 이하 공극의 친수성 시린지 필터(PVDF-H, PES ...)를 이용해 필터링 한다.
위 방법은 일반적인 산 용액을 이용한 가수분해 방법입니다. 구성아미노산을 제외한 대부분의 아미노산들은 이러한 산성, 고온 환경에서 파괴가 되기에 분석 가능한 아미노산의 종류가 18~20종으로 제한됩니다.하지만 구성 아미노산 중 분자 구조 내 황을 포함하는 황 함유 아미노산, 대표적으로 시스틴, 시스테인, 메티오닌 혹은 트립토판의 경우 이러한 전처리 과정에서 분자 구조가 변성 혹은 파괴가 되어 추가적인 전처리가 필요합니다.
이들은 질소 퍼징 과정 후 남아있는 일부 산소와도 반응하여 자체적인 산화가 일어나 개별 피크들로 나눠지는 현상이 발생합니다.
먼저 황 함유 아미노산인 시스틴, 시스테인, 메티오닌의 경우 각각 시스테인 산(Cysteic Acid)와 메티오닌 술폰(Methionine Sulfone)으로 산화를 시켜야 합니다.
즉, 단백질 시료의 산화 후 산 가수분해가 필요합니다.
이러한 전처리 과정을 단백질 산화 가수분해라고 합니다.
산화된 단백질 시료는 그대로 가수분해 과정을 거치게 됩니다.
단백질 산화에 필요한 용액은 다음과 같은 절차로 준비 됩니다.
1. 단백질 산화 용액(Oxidation Solution)
1. 23 M 포름산(Formic Acid)에 0.55 w/v% phenol을 첨가해 준비합니다.
2. 30 w/v % 농도의 과산화수소 용액을 준비합니다.
3. 포름산 용액(2번 용액)과 과산화 수소 용액(3번 용액)을 9:1 v/v% 비율로 혼합합니다.
4. 혼합한 용액을 상온에서 30분간 방치합니다.
단백질 산화는 다음과 같은 과정을 거칩니다.
1. 시료를 동결 건조하여 수분을 제거한다.
2. 만약 시료에 다량의 지질(Lipid)이 함유돼있을 경우 속슬렛과 벤진(petroleum ether)을 이용해 지질을 제거한다.
3. 시료를 50 ~ 100 mg 정도 정확히 정량하며 내열 용기에 담는다.
*이때 용기 벽면에 묻는 시료를 최소화한다.
4. 시료에 단백질 산화 용액 5 ml를 첨가합니다.
이 과정은 상온에서 1시간 혹은 상온 저온 아이스 베스 내에서 16시간동안 이뤄집니다.
5. 단백질 산화를 멈추기 위해 메타중아환산나트륨(sodium pyrosulfite, Na2S2O5)를 0.9 g 첨가합니다.
이 반응은 매우 격렬합니다, 또한 이산화황 가스를 배출하기 때문에 반드시 퓸후드 내에서 진행돼야 합니다.
6. 반응이 끝날때 까지 조심스럽게 돌립니다. 반응이 끝나면 더이상 거품이 나오지 않습니다.
7. 이후 동일한 과정을 통해 산 가수분해를 진행합니다.
과의산(Performic Acid)를 통한 단백질 산화는 그 과정이 위험할 수 있습니다.
따라서 반드시 실험 보호구를 착용하신 뒤 엄격한 관리감독 하에 진행하시는 것이 강력하게 권고됩니다.
하지만, 여전히 중요한 분석 대상 중 하나인 트립토판의 경우 위 두가지 방법으로도 정확한 정량 및 정성이 불가능합니다.
이는 트립토판의 구조적 성질에 기인하며 트립토판 분석을 위한 전처리가 따로 필요합니다.

트립토판은 구성 아미노산 중 분자량이 가장 크며 분자 구조의 특성상 일반적인 가수분해시 수율이 저조합니다.
따라서 트립토판은 다른 방식의 가수분해가 진행돼야 하며 이때 대표적으로 사용되는 방법은 4 M 의 수산화 용액(NaOH, KOH)를 사용하는 것입니다.
보다 자세한 내용은 첨부된 시료 전처리 방법을 참고해주시면 감사하겠습니다.